在当今社会,肺癌已经成为全球范围内的重大健康挑战,对人类健康和社会发展造成了巨大影响。世界卫生组织数据显示,肺癌是全球范围内最常见的癌症之一,也是导致癌症死亡的主要原因之一,其发病人数位列全球癌症发病人群第二位、中国癌症人群第一位,2022年全球共180万人因肺癌死亡,占总数的18.7%,中国肺癌发病人数达到97.8万,分别占同年全球及中国总癌症新发病例的11.5%和20.6%,预计至2030年,中国肺癌新发病例占全球的比例将达到44.5%。每年将有数百万人因肺癌而丧生,会给患者的家庭和整个社会带来了极大的损失和创伤。当下肺癌患者不再局限于老年人群体,年龄呈现年轻化趋势,使得肺癌防治工作愈发迫切和复杂,对肺癌的早期筛查和控制有待进一步加强。
面对以上情况,武汉理工大学张甜教授团队研发出了一种集成式电化学生物传感器,仅取患者少量的血液样本即可精确、快速地检验样本中的ctDNA,从而实现对患者体内非小细胞肺癌的精准筛查,为肺癌的防治与早筛提供了新思路。
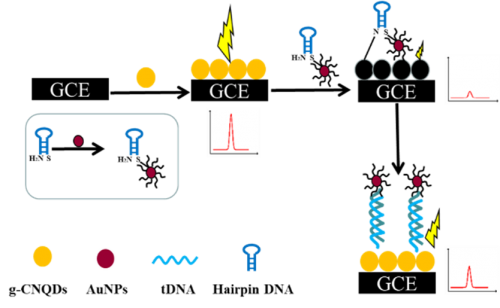
图为电化学生物传感器原理图
该团队所研发的电化学生物传感器是利用纳米金(AuNPs)标记的发夹DNA(haiDNA)作为敏感元件,通过共价键或化学吸附在已处理的玻碳电极(GCE)的表面,当haiDNA能与目标DNA呈碱基序列互补,并在适当的温度、离子强度、pH、缓冲液等杂交条件下,探针haiDNA与溶液中的目标DNA发生特异性选择杂交,从而导致电极表面结构的变化,通过电化学发光能量共振转移体系控制电化学发光,由此引起的电信号变化即电化学发光强度可表征目标DNA的浓度。团队对传感器的分析选择性能、血浆环境检测性能进行了表征,并通过了生物传感器实际样本的测试,成功证明该电化学生物传感器可用于非小细胞肺癌患者的液体活检。
该项目成功合成发光强度更高的硫代乙醇酸修饰的硫化镉量子点硒化镉量子点等的发光材料,通过傅里叶变换红外光谱分析、X射线衍射分析等手段表征,并将其运用到电化学生物传感器中,大大提高了传感器的检测精度。同时创新性地采用ECL-RET技术,对血液中的ctDNA进行超灵敏检测,检测下限低至10-18次方,且在检测成本低的同时,本项目的检测方法不会对患者造成辐射危害,亦不会出现假阳性造成过度诊断和过度治疗,有助于肺癌早筛的推广与普及。
该项目已有多项国家专利支撑,并在诸多专业性比赛中取得优异奖项。充足的理论成果和技术创新也证明了该项目肺癌早筛技术的可发展性,未来希望该技术在已取得的阶段性成果基础上不断创新突破,实现精准高效肺癌早筛技术的产业化,做国民健康的守护大使。
